De-a lungul tuturor etapelor proceselor reversibile de
încălzire şi de răcire, moleculele emit continuu energie şi sub formă de fotoni
şi în mod difuz.
Menţionăm că emisia de energie în procesele reversibile de
încălzire şi de răcire ale moleculelor şi atomilor izolaţi a fost analizată şi
în paragraful 11.5 „Emisia de lumină şi viteza luminii” din [1] şi este
prezentată, cu aceeaşi denumire şi într-o postare pe prezentul blog.
Pentru a analiza emisia de energie în procesele termice,
trebuie să determinăm diferențiala energiei moleculei, adică să determinăm
creşterea funcţiei care exprimă energia moleculei raportată la tangenta la
funcţie într-un punct al ei.
Conform [2] pag. 304, diferenţiala funcţiei y = f(x) se
determină cu relaţia
 (44)
(44)
Aplicând relaţia (44) energiei moleculei exprimată prin
relaţia (11.73) din [1], se obţine:
 (45)
(45)
Înmulțind și împărțind cu wn
în membrul doi al relației (45), se obţine
(46)
Cum Em și wn
sânt mărimi pozitive, semnul creşterii dEm este acelaşi cu
semnul creşterii dwn, adică:
-
wn
= const şi dwn = 0, rezultă
că şi dEm = 0 şi Em = const, respectiv En =
const și Es = const.
-
creşte wn
şi dwn > 0, rezultă că şi
dEm > 0 şi creşte şi Em, respectiv cresc și En
și Es;
-
scade wn
şi dwn < 0, rezultă că şi
dEm < 0 şi scade şi Em, respectiv scad și En
și Es;
Aceste trei cazuri reprezintă, de fapt, cazurile regimului
termic în care se poate afla molecula, în schimbul de energie cu mediul
înconjurător, cu câmpul universal de energie, descrise în subparagraful
11.7.6.1 din [1] şi pe care le reproducem:
-
staţionar, Eim = Eem,
adică energia care intră în moleculă este egală cu energia care iese din
moleculă,
-
de încălzire, Eim > Eem,
adică energia care intră în moleculă este mai mare ca energia care iese din
moleculă şi
-
de răcire, Eim < Eem,
adică energia care intră în moleculă este mai mică decât energia care iese din
moleculă.
Aşa cum rezultă din toată analiza de mai sus, molecula,
oriunde s-ar afla în câmpul universal de energie, este tot timpul conectată şi
se află într-un schimb permanent de energie cu acesta, indiferent de regimul
termic în care se găseşte.
În mod natural, sub acţiunea legii atracţiei dintre energii,
molecula tinde şi se stabilizează în regimul termic staţionar de valori Em
şi wn, deoarece în acest
regim, forţele de atracţie şi centrifuge din interiorul său echilibrează
complet acţiunea externă a forţei de atracţie a câmpului universal de energie.
Pentru a trece molecula din regimul staţionar în regimul de
încălzire, adică pentru a creşte fluxul de energie prin moleculă peste valoarea
corespunzătoare regimului staţionar, forţei externe a câmpului universal de
energie trebuie să i se alăture încă o forţă externă care să fie capabilă să
producă creşterea fluxului de energie. Fluxul de energie prin moleculă creşte
până la valoarea la care forţele de atracţie şi centrifuge din interiorul
moleculei ajung să echilibreze acţiunea comună a forţelor externe, când
molecula trece din nou în regim staţionar cu un surplus DEm de energie. Creşterea forţelor de atracţie şi
centrifuge din interiorul moleculei se produce pe seama creşterii vitezei
unghiulare de rotaţie wn a
nucleelor atomilor moleculei cu Dwn,
corespunzătoare surplusului DEm
de energie.
După încetarea acţiunii forţei externe, rămânând ca exterioară
doar forţa câmpului universal de energie, acţiunea combinată a forţelor de
atracţie şi centrifuge din interiorul moleculei depăşeşte forţa externă şi
regimul staţionar realizat la surplusul DEm
de energie se strică.
Sub acţiunea forţelor de atracţie şi centrifuge din interiorul
său, molecula începe să arunce mai multă energie în exterior, surplusul DEm de energie începe să diminueze
şi, corespunzător diminuează şi creşterea Dwn
a vitezei unghiulare de rotaţie wn
a nucleelor moleculei. Molecula trece într-un regim liber de răcire care
continuă până la epuizarea completă a surplusului DEm de energie şi molecula revine la regimul
staţionar iniţial cu Em şi wn.
Trebuie să menţionăm că forţa exterioară adăugată la forţa
câmpului universal de energie poate acţiona şi în sens invers celui descris mai
sus. Adică, în loc să sporească energia moleculei să o micşoreze cu (– DEm),
cum se întâmplă în instalaţiile frigorifice. În asemenea cazuri, molecula trece
din regimul staţionar într-un regim de răcire. La un moment dat, şi în asemenea
cazuri, la echilibrul forţelor interne cu forţele externe se instalează un
regim staţionar la un deficit de – DEm
de energie şi o diminuare de – Dwm
a vitezei unghiulare de rotaţie.
La încetarea forţei exterioare care a provocat răcirea, sub
acţiunea forţelor de atracţie ale energiei structurilor de energie din jurul
nucleelor, care tinde către infinit în zonele polare ale găurilor lipsite de
energie, începe procesul de încălzire, adică de creştere a fluxului de energie
prin moleculă şi completarea deficitului ei de energie. Procesul de încălzire
se încheie prin revenirea la regimul normal de stabilizare, adică atât
deficitul de energie cât şi diminuarea vitezei unghiulare de rotaţie devin
zero, – DEm = 0 şi – Dwm = 0, valori la care, forţele
centrifuge ale structurilor de energie din jurul nucleelor echilibrează şi
stabilizează fluxul de energie prin moleculă astfel încât energia care intră în
moleculă este constantă şi egală cu energia care iese din moleculă.
Astfel se petrec procesele termice în moleculă, indiferent de
mărimea sau complexitatea ei, dar şi în oricare corp material de pe planeta
noastră, din sistemul planetar, din Galaxie şi chiar din Univers. Prin
înlocuirea cuvântului „moleculă” cu cuvintele „corp material”, toată analiza de
mai sus este aplicabilă oricărui corp material format din molecule, deoarece
proce-sele termice din corpul material constau dintr-un ansamblu de procese
moleculare ce se petrec identic şi simultan, în toate moleculele corpului
material.
În încheierea analizei, este necesar să facem observaţia că
relaţia (46)119) aminteşte de relaţia entropiei, dacă ţinem seama de
echivalenţa wm »To.
În înţelesul său clasic, entropia (S) este definită în [3] ca o funcţie de stare a
unui sistem termodinamic exprimată prin relaţia
(47)
pentru sisteme reversibile, şi prin relaţia
(48)
pentru sisteme ireversibile.
Deoarece To > 0, dQ şi dS au întotdeauna acelaşi semn în
ambele relaţii (47) şi (48). Rezultă că acumularea de căldură înseamnă
creşterea entropiei, iar cedarea de căldură înseamnă scăderea entropiei
sistemului.
Conform principiului al doilea al termodinamicii, sensul transformărilor
termice spontane este acela că orice proces spontan tinde să treacă de la o
stare mai puţin probabilă la una mai probabilă, parametrul de stare care
determină sensul transformării de energie fiind entropia S. Prin
urmare, orice variaţie a entropiei unui corp material înseamnă schimb de căldură
(de energie) între corp şi mediul înconjurător. Dacă entropia creşte, corpul
primeşte energie şi se încălzeşte, iar dacă entropia scade, corpul se răceşte.
Aşa fiind înţeles principiul entropiei în fizica
contemporană, pe considerentele acestuia este clădită teoria „ordinii şi
dezordinii” şi este trasă concluzia că Universul evoluează implacabil spre
entropia zero, adică spre moarte şi apoi renaşterea printr-un nou bing-bang.
În fond, principiul entropiei nu numai că nu fundamentează
aberaţii ca cele din alineatul precedent, ba dimpotrivă se dovedeşte a fi o
consecinţă şi o confirmare a legii fundamentale a forţei de atracţie a energiei
universale. Conform analizei de mai sus, principiul entropiei corespunde
concepţiei elaborate în [1] şi se încadrează în analiza proceselor termice
efectuată de-a lungul prezentului paragraf.
Respingând aberaţiile fizicienilor contemporani, care nu
sânt decât un pamflet umoristic, nu putem să trecem cu vederea meritele
deosebite ale fizicianului Rudolf
Clausius, cel care a formult şi fundamentat principiul entropiei. Într-o epocă
în care cercetarea se baza preponderent pe rezulatae obţinute în experimente
întâmplătoare, Rudolf Clausius s-a ridicat deasupra lor şi a intuit şi
sintetizat corect observaţiile adunate asupra fenomenelor termice, reuşind să
fundamenteze un principiu care este consecinţa directă a uneia dintre legile
fundamentale ale Universului. Tot respectul pentru un asemenea mare fizician.
Într-adevăr, să revenim la relaţiile lui Clausius (47) şi
(48): dS = 0 înseamnă şi dQ = 0 şi, implicit, T = constant. Şi dacă o asemenea
stare este extinsă la nivelul Universului, înseamnă o totală liniştire
energetică la întreaga sa scară, înseamnă că pe tot cuprinsul Universului nu
mai există energii diferite în două puncte diferite. Totodată, asta înseamnă şi
încetarea oricărei mişcări, în întreg Universul, înseamnă echilibrarea completă
a forţelor de atracţie dintre diferitele elemente de energie din întreg
Universul. Dar, deşi teoretic există o asemenea posibilitate, practic ea nu se
poate realiza deoarece, Universul fiind bântuit de un nesfârşit număr de
mişcări giroscopice de tipul galaxiilor, care-şi perpetuează existenţa prin
vânturarea unor enorme cantităţi de energie şi prin dispariţia treptată într-un
loc şi apariţia treptată în alt loc, perpetuarea existenţei şi evoluţiei
galaxiilor este veşnică. Aşa că Universul este şi va fi veşnic.
Aducerea în discuţie a Universului dar şi faptul că
evoluţiile caracteristice etapelor extreme de pe figura 1 din postarea (I) au
desfăşurări cosmice, ne determină ca de analiza acestora să ne preocupăm în
postarea (III).
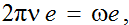






Este explicată emisia de energie în molecule şi atomi şi este prezentată scara etapelor proceselor reversibile de încălzire şi răcire, în funcţie de viteza unghiulară de rotaţie a nucleelor.
RăspundețiȘtergere